ARACELI ARTEAGA JIMÉNEZ, LUCIANO MARTÍNEZ BALBUENA
Profesores de la Facultad de Ingeniería Universidad Anáhuac Querétaro
Resumen
Los tintes son una fuente de contaminaciónambiental con un impacto negativo en elambiente al ser tóxicos, cancerígenos e inclusocon la capacidad de alterar la informacióngenética de un organismo. Las aguas residuales textiles generalmente contienen una cantidadconsiderable de coloran- tes azoicos; es decir, que contienen el cromóforo en su estructuramolecular, el cual les confiere alta estabilidad química que los hace muy resistentes a ladegradación por fotólisis. En el presente trabajose explica un método experimental de remociónde colorantes azoicos del agua.
Introducción
El agua es un recurso esencial para la vida y es propulsora del desarrollo en las sociedades. Por esta razón los asentamientos humanos siempre se han dado alrededor de grandes fuentes de agua. La cantidad de agua dulce existente en la tierra es limitada y monitorear su calidad es importante tanto para mantener su ciclo, recargando losacuíferos naturales, como para poder suministrar el consumo humano, industrial y agrícola. La calidad del agua puede ser afectada por la presencia de agentes infecciosos, productos químicos tóxicos o radiaciones. Una fuente de agua contaminada es igual a no poder disponer de ella. Por lo tanto, la contaminación del agua es un problema que afecta en dos vertientes, por un lado, al mantenimiento y crecimiento sano de los ecosistemas y por el otro, aldesarrollo económico de las sociedades. Así, la disponibilidad del agua puede considerarse como una medida de la calidad ambiental en cierta región. En un país el conocimiento de las características fisicoquímicas y bacteriológicas del agua es muy importante para establecer su demanda y uso en las diferentes actividades productivas y en el abastecimiento de sus poblaciones. El consumo excesivo y la contaminación del agua en cualquier región genera efectos sobre los ecosistemas y problemas socioeconómicos; principalmente al generar la necesidad de explotar los mantos acuíferos, provocando un incremento en los costos asociados con el manejo y la disposición del recurso. En México, porejemplo, anualmente se utilizan aproximadamente 72 mil millones de m3 de los cuales el 78% se emplea en laagricultura; el resto es destinado a la industria, al uso doméstico y al pecuario.
El grado de pureza del agua se establece a través de índices definidos en función de parámetros físicos, químicos ybiológicos. Por ejemplo, la transparencia, turbidez, color, olor, sabor, temperatura, conductividad eléctrica y pH.
Contaminación del agua en México
En México, las principales fuentes de contaminación del agua son los desechos industriales y municipales que dotan de microorganismos y sustancias químicas al agua disponible. Las actividades agrícolas también agregan contaminantes al agua como fertilizantes, pesticidas y sales [1]. La Comisión Nacional del Agua (Conagua) es elorganismo encargado de dar tratamiento a las aguas residuales y monitorear su calidad a través de los siguientesindicadores:
- Demanda Bioquímica de Oxígeno a cinco días (DBO5): que mide la materia orgánica susceptible a descomponerse por bacterias, es decir que es biodegradable.
- Demanda Química de Oxígeno (DQO): la cual mide la cantidad de materia orgánica que es degradada por mediosquímicos.
- Sólidos Suspendidos Totales (SST): una medida de la cantidad de sólidos presentes por procesos de erosiónhídrica.
El tratamiento de aguas residuales por parte de la Conagua se realiza tanto a desechos municipales comoindustriales. Sin embargo, el volumen en el tratamiento de aguas residuales industriales es muy pequeño en comparación con el de aguas municipales. Los procesos se realizan en plantas tratadoras a través de las técnicas delodos activados, lagunas de estabilización y procesos de tratamiento primario avanzado [2]. Es decir, los procesosconsisten en distintas etapas que inician con la separación física de sólidos grandes a través de un sistema de rejillas yla eliminación de sólidos densos, como la arena, mediante sedimentación. Posteriormente, se realiza un tratamiento fisicoquímico y biológico para disminuir los agentes orgánicos disueltos. No obstante, los tratamientos empleados no son suficientes para eliminar del agua contaminantes orgánicos, como los colorantes, metales y contaminantes emergentes, como fármacos y plaguicidas. Por lo tanto, es necesario implementar nuevos procesos con la capacidad de remover estos compuestos químicos.
En las últimas dos décadas se ha logrado degradar una gran cantidad de contaminantes orgánicos usando métodos deoxidación avanza- dos. Donde el objetivo es generar radicales de oxidación que mineralizan los contaminantes. Otrosmétodos que han mostrado alta eficiencia en la remoción utilizan la adsorción sobre la superficie de materiales naturalesporosos como el carbón activado, arcillas, zeolitas y diatomeas, entre otros [3, 4]. Por otro lado, en los últimos años hay uncreciente interés en el uso de soluciones micelares acuosas porque permiten remover un amplio espectro decontaminantes; por ejemplo, el método ha sido eficaz para remover metales pesados, al mismo tiempo colorantes,fármacos y pesticidas [5].
En este trabajo se explica el proceso de ex- tracción de un colorante mediante el sistema de separación de fasesempleando un surfactante no iónico.
Metodología
La remoción de contaminantes empleando soluciones micelares consiste en diluir un surfactante no iónico en agua, el cualse encargará de solubilizar el contaminante que se desea remover.
Un surfactante es una molécula formada por una cabeza polar (afín al agua) y una cadena hidrocarbonada apolar. Al mezclarse con el agua tienden a migrar hacia la superficie acuosa embebiendo su cabeza y orientando su tallo hidrofóbico al aire. El aumento de surfactante en la interface ocasiona una disminución de la tensión superficial del agua. Cuando la concentración de surfactante alcanza un valor umbral conocido como concentración micelar crítica (CMC), las moléculas forman estructuras en el interior de la solución acuosa conocidas como micelas, donde los tallos hidrocarbonados se encierran evitando el contacto con el agua (verFigura 1).
Las micelas pueden emplearse para remover contaminantes del agua mediante el método de extracción depunto de nube. Este consiste en agregar surfactante a la disolución de contaminante, luego incrementar la temperatura de la solución para promover la formación de agregados micelares que solubilizan elcontaminante y así inducir la separación de la solución acuosa en dos fases inmiscibles. La característica dela fase precipitada es su alto contenido micelar y de contaminante, mientras que la fase coacervada contieneuna concentración muy diluida de ambos componentes (esta segunda fase se considera agua libre de contaminantes).
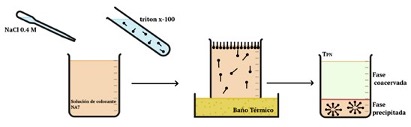
El objetivo del presente trabajo es emplear la técnica de extracción de punto de nube para remover el colorante azoico naranja ácido 7, altamente empleado en la industria textil. Para lograr este objetivo se usaron 35 ml desolución de colorante a una cierta concentración inicial, C0. A esta se le agregan 10 ml de una solución diluida delsurfactante triton x-100 a una alta concentración y una disolución de NaCl a 0.4
M. Para mantener constante el pH de la mezcla se agregó solución buffer a pH 4. Un esquema del procedimiento semuestra en la Figura 1.
Para calcular el porcentaje de extracción, es decir la cantidad de colorante que se removió de la solución conrespecto a la concentración inicial, se emplea la siguiente relación:
Donde la concentración inicial y final del colorante se calcula mediante la técnica de espectrofotometría UV-Vis y una curva de calibración que relaciona la absorbancia óptica de la disolución con su concentración de colorante.
Resultados y conclusiones
Con este método se logra un porcentaje de extracción de hasta el 90% de colorante naranja ácido 7. Un conjunto deimágenes que a simple vista muestran su eficiencia se presentan en la Figura 2.
Como se muestra en la Figura 2, a mayor cantidad de surfactante se presenta mayor decoloración de la soluciónindicando que el agua recuperada contiene menos colorante. La razón principal de este fenómeno se debe alincremento de las micelas en la solución. Desde un punto de vista molecular el coloran- te queda atrapado en los talloshidrofóbicos del surfactante debido a fuerzas físicas fuer- tes, como la electrostática, y débiles, como los puentes dehidrógeno (ver Figura 1).
De la Figura 2 también puede observarse que la fase precipitada está contenida en un volumen muy pequeño, loque representa una ventaja para iniciar otra etapa en la que se degrade o mineralice el contaminante. Hasta dondese ha explorado, el colorante naranja ácido 7 puede degradarse al ser
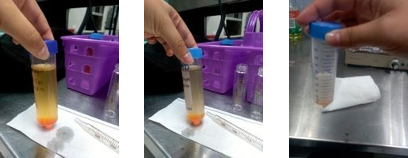
Figura 2. Separación de fases de la disolución de colorante. La fase precipitada confina el colorante en un volumen pequeño mientras que elsobrenadante es el agua recuperada. La baja coloración de la fase coacervada es proporcional a la cantidad de surfactante empleado.
irradiado con una lámpara de xenón (que simula la radiación solar) emitiendo en un rango de longitud de onda entre190 y 1000 nm; es decir, el colorante puede mineralizarse mediante fotólisis. En la Figura 3 se muestra ladecoloración de una solución de naranja ácido 7 a través de la irradiación de la lámpara de xenón. Una hipótesis quesurge de estos resultados es que, al usar el método de punto de nube para confinar el colorante a un volumen pequeño,el proceso de fotólisis será más eficiente pues el haz de luz emitido por la lámpara puede enfocarse directamente en el colorante.
Se concluye que es posible implementar metodologías fáciles, rápidas, seguras y de bajo costo para eliminarcontaminantes de los cuerpos de agua. Además, enfatizar la urgencia de agregar estas nuevas metodologías en las plantas de tratamiento de agua del país. En la Universidad Anáhuac Campus Querétaro se investiga a escala laboratorio posibles mecanismos para la integración de estos nuevos métodos.

Referencias:
Monforte-García, G. & Cantú-Martínez, P. (2009). Escenario del agua en México. Culcyt/Recursos Hídricos, 6(30), 31-40.
Comisión Nacional del Agua. (2014). Estadísticas del agua en México. Secretaría del Medio Ambiente y Recursos Naturales.
Torimoto, T., Ito, S., Kuwabata, S. & Yoneyama, H. (1996). Effects of Adsorbents Used as Supports for Titanium
Hadjltaief, H. B., Galvez, M. E., Zina, M. B., & Da Costa,
P. (2019). TiO2/clay as a heterogeneous catalyst in photocatalytic/photochemical oxidation of anionic reactive blue 19. Arabian Journal of Chemistry, 12(7), 1454-1462.
Bhatt, D. R., Maheria, K. C., & Parikh, J. K. (2016). Determination of thermodynamics and design parameters for ionic liquid-induced cloud point
Dioxide Loading on Photocatalytic Degradation of Propyzamide. Environ. Sci. Technol., 30(4), 1275-1281. extraction of Coralene red dye. International Journal of Environmental Science Technology, 13, 589-598.

